Tối 18.9, GS.TS Trương Việt Dũng, Chủ tịch Hội đồng đạo đức trong nghiên cứu y sinh học Quốc gia (Hội đồng Đạo đức), xác nhận vaccine Nano Covax của Công ty Nanogen đạt các yêu cầu về an toàn và tính sinh miễn dịch.
 |
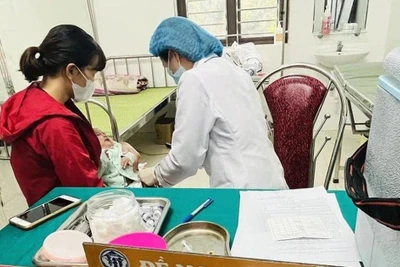
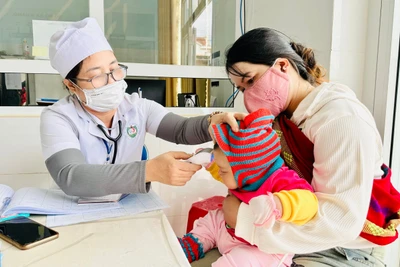
| Tiêm thử nghiệm vaccine Nano Covax trên tình nguyện viên. Ảnh: Hải Nguyễn |
Cuộc họp thẩm định kết quả giai đoạn 3a, bao gồm tính sinh miễn dịch, bổ sung, kết quả bước đầu giai đoạn 3b của vaccine COVID-19 Nano Covax của Nanogen đã được tổ chức vào chiều nay (18.9). GS Dũng cho biết hội đồng chuyên môn sẽ sớm có thông tin báo chí chính thức về kết quả cuộc họp này.
Hiện toàn bộ hồ sơ, dữ liệu của vaccine Nano Covax đã được chuyển sang Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế) để tiếp tục xem xét trước khi trình Bộ Y tế đề xuất cấp giấy đăng ký lưu hành.
Theo thông tin từ Hội đồng Đạo đức, tiến độ triển khai nghiên cứu thử nghiệm lâm sàng ứng viên Vaccine COVID-19 Nano Covax đến nay đang ở giai đoạn 2 của pha 3 (pha 3b).
Thử nghiệm lâm sàng ứng viên vaccine Nano Covax bao gồm 3 giai đoạn. Cụ thể như sau:
Giai đoạn 1: trên 60 người tình nguyện từ 18 đến 50 tuổi, gồm 3 mức liều 25mcg; 50mcg và 75mcg, mỗi mức liều có 20 người tham gia, kéo dài từ tháng 12.2020 đến tháng 7.2021, với mục tiêu đánh giá tính an toàn và thăm dò tính sinh miễn dịch của vaccine trên người tình nguyện.
Giai đoạn 2: trên 560 người tình nguyện từ 18 tuổi trở lên, gồm 4 nhóm (nhóm tiêm giả dược (placebo) 80 người; 3 nhóm tiêm vaccine với 3 mức liều 25mcg; 50mcg và 75mcg, mỗi mức liều 160 người).
Ngay khi có kết quả đánh giá giữa kỳ giai đoạn 1, Bộ Y tế đã phê duyệt đề cương nghiên cứu thử nghiệm lâm sàng giai đoạn 2, thời gian nghiên cứu từ tháng 2.2021 đến tháng 2.2022, với mục tiêu đánh giá tính an toàn và tính sinh miễn dịch của vaccine để chọn được liều tối ưu sử dụng trong thử nghiệm lâm sàng giai đoạn 3.
Giai đoạn 3: thử nghiệm với mức liều 25mcg, trên 13.000 người tình nguyện từ 18 tuổi trở lên, chia thành pha 3a và pha 3b, mục tiêu nghiên cứu là đánh giá tính an toàn, đáp ứng sinh miễn dịch và hiệu lực bảo vệ của ứng viên vaccine Nano Covax.
Trước đó, ngày 7.8.2021, Hội đồng Đạo đức đã họp khẩn cấp để nghiệm thu kết quả TNLS giai đoạn 1, đánh giá kết quả giữa kỳ TNLS giai đoạn 2.
Ngày 29.8, Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, đã họp và yêu cầu nhà sản xuất vaccine Nano Covax bổ sung thêm dữ liệu.
Về hồ sơ chất lượng: Hội đồng đề nghị Công ty Nanogen bổ sung, cập nhật một số nội dung theo ý kiến của Tiểu ban chất lượng theo hình thức cuốn chiếu.
Về hồ sơ dược lý, lâm sàng: Căn cứ kết quả thẩm định hồ sơ lâm sàng của Trung tâm Dược lý lâm sàng - Đại học Y Hà Nội và kết luận của Hội đồng Đạo đức ngày 22.8, Hội đồng tư vấn đề nghị Nanogen bổ sung, cập nhật thêm dữ liệu an toàn cho toàn bộ người đã được tiêm ít nhất một liều vaccine, giải thích rõ về các trường hợp sự cố bất lợi nghiêm trọng (SAE) tới nay.
Về tính sinh miễn dịch, công ty cần bổ sung, cập nhật dữ liệu theo đề cương sửa đổi mới nhất được Hội đồng Đạo đức thông qua, bao gồm đánh giá tính sinh miễn dịch trên các biến chủng mới (biến chủng Delta, biến chủng Alpha...). Ngoài ra, cỡ mẫu đánh giá tính sinh miễn dịch cần thực hiện theo đúng đề cương nghiên cứu đã được thông qua.
Về hiệu quả bảo vệ, Hội đồng tư vấn đề nghị Công ty Nanogen phối hợp nhóm nghiên cứu để phân tích, bàn luận về mối liên quan giữa tính sinh miễn dịch của vaccine và hiệu quả bảo vệ tối thiểu 50% (theo hướng dẫn của Tổ chức Y tế Thế giới) dựa trên các dữ liệu y văn.
Đến nay, ngoài Nano Covax, Việt Nam còn có 2 ứng viên vaccine COVID-19 khác đang triển khai thử nghiệm lâm sàng. Đó là Covivac- vaccine do Việt Nam nghiên cứu, phát triển và vaccine ARCT-154 nhận chuyển giao công nghệ mRNA từ Mỹ.
https://laodong.vn/y-te/hoi-dong-dao-duc-thong-qua-vaccine-nano-covax-955073.ldo
Theo Thùy Linh (LĐO)